Difference between revisions of "Bience"
| Line 104: | Line 104: | ||
- Torulopsis, Pichia et Candida spp.<br><br> | - Torulopsis, Pichia et Candida spp.<br><br> | ||
| − | Ces organismes ne | + | Ces organismes ne présentent pas de danger particulier pour l'homme en bonne santé. Il est cependant important de les éviter dans la bière au risque d'en gâcher le goût. Une infection même légère, sans nécessairement altérer le goût de la bière, peut provoquer une nouvelle fermentation en bouteille et la faire mousser excessivement. Une première indication d'une possible infection se fait au goût et à l'odeur. Une odeur acide indique souvent la présence d'une bactérie. Il est aussi possible de les détécter en mesurant le pH (à condition de déjà connaître le pH final voulu pour une recette donnée). Nous testons régulièrement les bières en cuve si le moindre doute plane. Pour cela, nous utilisons des cultures solide contenant un milieu particulier de détection, le milieu Lee's Multi-Differential Agar (LMDA). Ce milieu contient tous les nutriment nécessaire à la croissance des organismes néfastes à la bière ainsi que du vert de bromocrésol qui joue le role d'indicateur de pH. Le milieu a une couleur bleue de base, pour un pH neutre. Il vire au jaune lorsque le pH baisse, ce qui indique que l'organisme présent produit de l'acide. De plus, la présence du carbonate de calcium insoluble à pH neutre, produit des halos jaunes autour des colonies produisant de l'acide. Nous ajoutons aussi parfois du cycloheximide qui est un puissant antibiotique contre les levure de bière. Cela permet d'isoler les organismes résistants sans détecter la souche de levure utilisée dans la recette.<br> |
''Recette LMDA 250 ml'' | ''Recette LMDA 250 ml'' | ||
- 2.5 g Yeast extract<br> | - 2.5 g Yeast extract<br> | ||
Revision as of 13:33, 11 January 2016
Bience (Bière et Science !) est un projet de R&D en microbiologie
Ce projet très sérieux a été initié par nos voisins, les brasseurs de La Nébuleuse, qui veulent mieux comprendre comment fonctionnent les levures qu’ils utilisent pour fabriquer leurs produits. Avec l’aide des biologistes de l’association, ils vont apprendre à dompter ces petites bêtes à Hackuarium.
Le projet a été présenté lors de l' Openhackuarium vol. 57 "Bière" (pas mal de détails sur la page discussion : Talk:Openhackuarium_vol._57_"Bière")
Premiers WE de travail
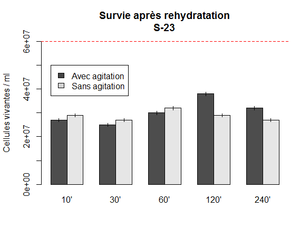
Première expérience : Survie de la S-23 après rehydratation
Objectif
Parfois, la levure ne fermente pas bien ou pas assez une fois le moût innoculé. Une des étapes qui n'était pas toujours systèmatique était la réhydratation. Le temps de réhydratation n'était pas toujours le même. Avec cette expérience, nous voulons savoir si le temps de réhydratation a des effets sur la survie.
Méthode
Réhydratation de la S-23 dans 10x le poids en eau. Ici 0.5 g dans 50 ml. Un falcon gardé sous agitation et l'autre sans. Les points sont mesuré à différent temps en récupérant 100 ul de chaque falcon qui sont ensuite dilués 10 000x et inoculé (2x 5 ul) sur des plaques d'agar. les colonies sont compté après 48h d'incubation à 30 C°. Le nombre de cellules vivante est calculé selon la formule : (nombre colonie x 200 x 10 000)
Résultat
On observe un pic à 2h sous incubation. Ce que cette expérience indique surtout, est que le temps de rehydratation n'a pas une très grande influence sur la survie. Il est donc possible de garder les levures dans le yeast tank au moins pendant 4 heures sans effet néfaste.
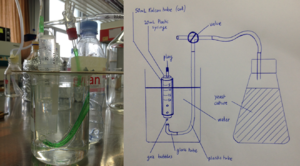
Prototype pour mesurer un volume de gas
Objectif
Pour pouvoir suivre la production de CO2 durant la fermentation, un instrument de mesure du volume de gas est nécessaire. L'objectif de ce prototype est de permettre de tester différentes configurations low-cost et low-tech et d'en comparer la précision.
Méthode
Construire un instrument de mesure du volume de gas produit par une culture de levure en fermentation pendant un temps donné.
Résultat
Le prototype 1 est décrit dans le schéma ci-dessous, ainsi que représenté par une photographie
Techniques utiles à la Bience
Culture solide
Principe
La culture sur plaque est un outil indispensable au bon Bientifique. Ces cultures permettent de répondre à un grand nombre de questions allant du nombre de cellules effectif d'une culture liquide, à la détection et l'identification des infections. Il existe un grand nombre de milieux différents en fonction des besoins. Ici, nous parlerons surtout de ceux que nous utilisons à la Nébuleuse. Principalement, nous utilisons un milieu à base de malt extract (de moût) dans lequel on ajoute du yeast extract maison, de l'agar et une pointe de sulfate de zinc.
Milieu basic: Recette
Il n'est pas nécessaire de travailler en condition stérile à part si l'on récupère les ingrédients à partir de stocks stérilisés.
À partir de milieu liquide (250 ml)
1. Utiliser un milieu liquide complet d'une gravité d'au moins 8 p° (couper à l'eau déminéralisée si nécessaire pour économiser).
2. Ajouter 3.75 g d'agar (1.5%) et bien mélanger. Passer eventuellement au microonde une minute pour aider à dissoudre.
3. Autoclaver le milieu puis laisser refroidir à température ambiante avant de stocker au frigo.
Travailler en condition stérile à partir de ce point
4. Au moment de couler les plaques, passer au microonde jusqu'à ce que tout le contenu redevienne liquide. Disposer les plaques en cercles autour de la flamme sous la hotte stérile et ajouter 5 ml de milieu pour les petites plaques et ~30 ml pour les grandes. Une fois l'agar polymerisé on stocke les plaques fermée au frigo dans un emballage stérile (réutiliser celui des boites).
Cultures liquides
Principe
Les culture liquides sont au coeur du projet Bience. Ces cultures sèrvent principalement à la propagation en masse des levures. Le milieu de culture que l'on utilise est composé de moût (extrait de malte) complété avec du yeast extract et du sulfate de zinc. On commence une culture à partir de levure sèche ou à partir d'une colonie sur culture solide afin d'en obtenir de grandes quantités. Les différentes étapes de 24h se déroulent dans des volumes croissant (1ml, 10 ml, 100 ml, 1 L, 10 L et 100 L). On utilise une gravité d'environ 8 P° jusqu'à 100 ml puis de 12 à 16 P° à partir de 1L.
Yeast extract : Protocol
Le yeast extract que nous utilisons est obtenu à partir de reste de levures récupéré au moment de la purge des cuves. Le "yeast slurry" est complété avec de l'eau déminéralisée (1:4) et chauffé à 80 C° pendant 2 jours avant d'être autoclavé. Cela a pour effet de lyser les cellules et d'extraire tous les nutriments nécessaires à la croissance des levures. On obtient alors une nette séparation entre les différents débris cellulaires ainsi que les restes de houblon et le yeast extract contenu dans la phase liquide. On récupère le surnageant avec une pipette sérologique au moment de l'utiliser.
Milieu liquide: recette
1 L
- 100 ml de yeast extract
- 900 ml de moût (à couper à l'eau si l'on veut une gravité plus basse)
- Pour le sulfate de zinc, diluer 0.0625 g dans 1 ml d'eau et ajouter 100 ul de cette solution dans les 1 L de milieu.
Autoclavez le milieu et il sera prêt à l'utilisation une fois refroidi.
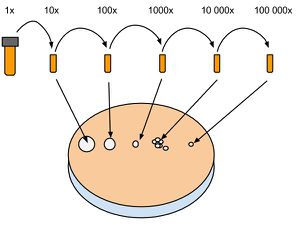
Comptage sur plaque
Principe
Le comptage sur plaque permet d'avoir une bonne estimation du nombre de cellules dans une culture liquide. Contrairement au comptage au spectrophotomètre, il est nécessaire d'attendre une nuit complète avant d'avoir le résultat. Cette technique donne un résultat plus fiable que le spectrophotomètre. Il est donc préférable de se fier au résultat sur plaque après 24h. La méthode consiste à effectuer une dilution en série d'une culture dont on aimerait connaître le nombre de cellules. Ensuite, 5 ul de culture dilué sont déposé sur une plaque de Culture solide. Le principe est que ces 5 ul contiennent un nombre de cellules suffisamment petit pour que chacune d'elle se divise en une colonie distincte. Les colonies sont ensuite comptées et le nombre de cellule d'origine est calculé selon la formule suivante : Cells/ml = #colonies*200*dilution.
Protocole détaillé
Cette technique nécessite de travailler sous la hotte de ventilation avec du matériel stérile.
1. Préparer 4 à 6 alicots (1.5 ml) selon la concentration estimée, en ligne sur un portoir et les numéroter. Ajouter 900 ml d'H2O stérile dans chaque tube.
2. Ouvrir la culture liquide à mesurer et récupérer 100 ul qu'on ajoute au tube numéro 1 (dilution 10x). Mélanger up and down avec la pipette et récupérer 100 ul à passer dans le tube numéro 2 (dilution 100x) et ainsi de suite.
3. Préparer une plaque de culture solide et noter sur le couvercle les numéros des tubes correspondant à leur dilution. Déposer 5 ul des dilutions voulues en ligne et attendre 5 à 10 minutes que les gouttes sèchent. Déposer la plaque fermée à l'envers dans l'incubateur à 30 C° et attendre que des petites colonies apparaissent. En général, une nuit.
4. Compter le nombre de colonies à partir de la dilution la plus basse possible. on compte en général les dilutions #4 (10 000x) ou #5 (100 000x). Un comptage d'une cinquantaine à une centaine de colonie donne un résultat plus précis que de compter une dizaine sur la dilution suivante.
5. Calculer selon Cells/ml = #colonies*200*dilution. Exemple : On compte 76 colonies sur la dilution #4. La culture d'origine contenait donc 76*200*10 000 = 1.52e+8 Cells/ml.
Comptage au spectrophotomètre
Principe
Le spectrophotomètre permet de mesurer la densité optique (OD) d'une solution. En réglant la longueur d'onde à 600 nm, il est possible d'avoir une bonne idée de la densité cellulaire d'une culture liquide. Cette mesure n'est pas très précise mais donne une bonne idée de l'ordre de grandeur et permet d'avoir un résultat rapide. On l'utilise en général avant de pitcher afin de déterminer le volume nécessaire. On confirme le résultat avec un comptage sur plaque. Il est nécessaire de diluer 50x à 100x une culture classique (1e+8 C/ml). On utilise donc les première ou deuxième dilutions de la série utilisée pour le comptage sur plaque.
Protocole détaillé
Il n'est pas necessaire de travailler en condition stérile une fois l'échantillon récupéré.
1. Allumer le spectrophotomètre afin de laisser la lampe chauffer. Il faut attendre au moins 15 minutes.
2. Effectuer une dilution jusqu'à obtenir une solution bien translucide (50 à 100x)
3. Prendre une cuvette adaptée au spectro et la remplir d'eau afin de l'utiliser comme "blanc". placer la cuvette dans la machine réglée à 600 nm et appuyer sur le bouton representant une cuvette pour calibrer.
4. On utilise la même cuvette que le blanc pour mesurer l'échantillon dilué. Il faut mesurer une OD comprise entre 0.3 et 0.8 afin d'être le plus précis possible. Diluer plus ou moins l'échantillon jusqu'à être dans le bon range.
5. Calculer 3e+6 cellules par OD selon la formule : OD*3e+6*dilution
Test de fermentation forcée
Il est nécessaire de travailler en conditions stériles
Le test de fermentation forcée permet d'avoir une idée de l'atténuation à atteindre pour une recette donnée. La valeur de gravité d'un moût peut descendre jusqu'à un certain point en fonction de la souche de levure utilisée. Ce test permet de determiner la valeur de ce point. Il est important de connaître cette valeur afin de ne pas laisser les levures trop longtemps une fois leurs ressources épuisées. C'est à ce moment là, en condition de stress, qu'elles relâchent des métabolites pouvant altérer le goût de la bière. Dans l'autre sens, il est important de ne pas embouteiller alors que cette valeur n'est pas encore atteinte au risque d'avoir une surpression dans les bouteilles.
Pour comprendre ce test, il faut savoir que les levures sont capable de pratiquer la fermentation en condition aérobie (en présence d'oxygène) et anaérobique (sans oxygène). La fermentation aérobie est plus efficace et plus rapide. C'est donc ce système que l'on veut leur faire utiliser. Il suffit de récupérer une petite quantité de moût après le pitch et de le placer dans un erlenmeyer sterile sur agitateur magnétique. La levure, grâce à l'agitation, aura accès à plus d'oxygène que dans la cuve et fermentera le moût plus rapidement. On mesure ensuite la gravité chaque jours jusqu'à ce que la valeur ne varie plus. On sait alors quelle valeur minimal de gravité l'on peut attendre dans la cuve. Une fois atteinte, on peut lancer le cold crash qui provoquera la sédimentation des levures. Attention à ne pas utiliser du matériel contaminé pour ce test. Une autre souche de levure ou de bactérie pourrait être capable de faire descendre la gravité plus bas que la souche présente dans la cuve.
Mesure de gravité
Détection d'infection
Principe
Il est très important d'avoir un moyen de détecter la présence d'autre microorganismes que la levure dans les cultures de levure, dans le moût et dans la bière après fermentation. Certaines bactéries produisent directement des off-flavors d'elles-même comme les lactobacilles alors d'autres induisent les levures présentes à produire des off-flavors. La bière est un environnement hostile pour la plupart des microorganismes (pH bas, éthanol, peu d'oxygène et beaucoup de CO2.) Les principaux microorganismes capable de croître dans la bière sont les suivants :
Gram-Positive Bacteria
- Lactobacillus spp.
- Pediococcus spp.
Gram-Negative Bacteria
- Acetic Acid Bacteria
- Zymomonas spp.
- Pectinatus spp.
- Enterobacteriaceae spp.
Levures sauvages
- Saccharomyces spp.
- Non-Saccharomyces spp.
- Brettanomyces spp.
- Torulopsis, Pichia et Candida spp.
Ces organismes ne présentent pas de danger particulier pour l'homme en bonne santé. Il est cependant important de les éviter dans la bière au risque d'en gâcher le goût. Une infection même légère, sans nécessairement altérer le goût de la bière, peut provoquer une nouvelle fermentation en bouteille et la faire mousser excessivement. Une première indication d'une possible infection se fait au goût et à l'odeur. Une odeur acide indique souvent la présence d'une bactérie. Il est aussi possible de les détécter en mesurant le pH (à condition de déjà connaître le pH final voulu pour une recette donnée). Nous testons régulièrement les bières en cuve si le moindre doute plane. Pour cela, nous utilisons des cultures solide contenant un milieu particulier de détection, le milieu Lee's Multi-Differential Agar (LMDA). Ce milieu contient tous les nutriment nécessaire à la croissance des organismes néfastes à la bière ainsi que du vert de bromocrésol qui joue le role d'indicateur de pH. Le milieu a une couleur bleue de base, pour un pH neutre. Il vire au jaune lorsque le pH baisse, ce qui indique que l'organisme présent produit de l'acide. De plus, la présence du carbonate de calcium insoluble à pH neutre, produit des halos jaunes autour des colonies produisant de l'acide. Nous ajoutons aussi parfois du cycloheximide qui est un puissant antibiotique contre les levure de bière. Cela permet d'isoler les organismes résistants sans détecter la souche de levure utilisée dans la recette.
Recette LMDA 250 ml
- 2.5 g Yeast extract
- 2.5 g Glucose
- 1.25 g Calcium carbonate (Craie blanche réduite en poudre)
- 3.75 g D'agar
- 0.025 g de NaCl
- 0.0055 g de Bromocrésol green
Souches de levures utilisées par la Nébuleuse
S-23
Propriétés
Souche de Fermentis [1] utilisée pour la production de lagers fruitée.
Bières
- Stirling
- Brewstach