Difference between revisions of "Bience"
(→S-23) |
|||
| Line 62: | Line 62: | ||
=== Morphologie et propriétés === | === Morphologie et propriétés === | ||
| − | |||
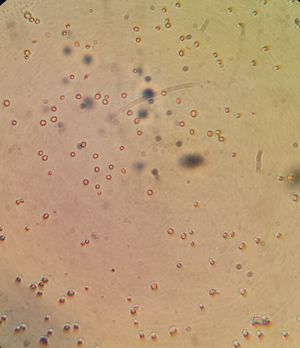
Les cellules apparaissent très petites et rondes en grossissement 100x. On distingue bien le nucléole en rouge en augmentant la lumière. Du point de vue des colonies, elles apparaissent très petites au bout de 24h sur milieu riche en malte, contrairement à la S-04 qui pousse plus rapidement. | Les cellules apparaissent très petites et rondes en grossissement 100x. On distingue bien le nucléole en rouge en augmentant la lumière. Du point de vue des colonies, elles apparaissent très petites au bout de 24h sur milieu riche en malte, contrairement à la S-04 qui pousse plus rapidement. | ||
== S-04 == | == S-04 == | ||
== MachuPitch == | == MachuPitch == | ||
Revision as of 15:33, 2 November 2015
Bience (Bière et Science !) est un projet de R&D en microbiologie
Ce projet très sérieux a été initié par nos voisins, les brasseurs de La Nébuleuse, qui veulent mieux comprendre comment fonctionnent les levures qu’ils utilisent pour fabriquer leurs produits. Avec l’aide des biologistes de l’association, ils vont apprendre à dompter ces petites bêtes à Hackuarium.
Le projet a été présenté lors de l' Openhackuarium vol. 57 "Bière" (pas mal de détails sur la page discussion : Talk:Openhackuarium_vol._57_"Bière")
Premiers WE de travail
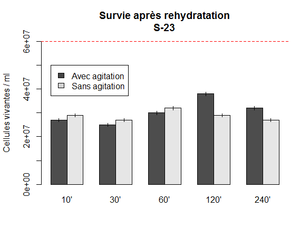
Première expérience : Survie de la S-23 après rehydratation
Objectif
Parfois, la levure ne fermente pas bien ou pas assez une fois le moût innoculé. Une des étapes qui n'était pas toujours systèmatique était la réhydratation. Le temps de réhydratation n'était pas toujours le même. Avec cette expérience, nous voulons savoir si le temps de réhydratation a des effets sur la survie.
Méthode
Réhydratation de la S-23 dans 10x le poids en eau. Ici 0.5 g dans 50 ml. Un falcon gardé sous agitation et l'autre sans. Les points sont mesuré à différent temps en récupérant 100 ul de chaque falcon qui sont ensuite dilués 10 000x et inoculé (2x 5 ul) sur des plaques d'agar. les colonies sont compté après 48h d'incubation à 30 C°. Le nombre de cellules vivante est calculé selon la formule : (nombre colonie x 200 x 10 000)
Résultat
On observe un pic à 2h sous incubation. Ce que cette expérience indique surtout, est que le temps de rehydratation n'a pas une très grande influence sur la survie. Il est donc possible de garder les levures dans le yeast tank au moins pendant 4 heures sans effet néfaste.
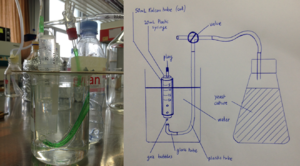
Prototype pour mesurer un volume de gas
Objectif
Pour pouvoir suivre la production de CO2 durant la fermentation, un instrument de mesure du volume de gas est nécessaire. L'objectif de ce prototype est de permettre de tester différentes configurations low-cost et low-tech et d'en comparer la précision.
Méthode
Construire un instrument de mesure du volume de gas produit par une culture de levure en fermentation pendant un temps donné.
Résultat
Le prototype 1 est décrit dans le schéma ci-dessous, ainsi que représenté par une photographie
Techniques utiles à la Bience
Culture solide
Cultures liquides
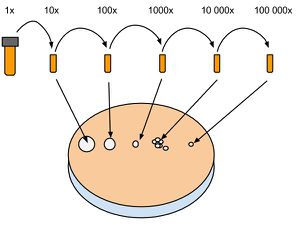
Comptage sur plaque
Principe
Le comptage sur plaque permet d'avoir une bonne estimation du nombre de cellules dans une culture liquide. Contrairement au comptage au spectrophotomètre, il est nécessaire d'attendre une nuit complète avant d'avoir le résultat. Cette technique donne un résultat plus fiable que le spectrophotomètre. Il est donc préférable de se fier au résultat sur plaque après 24h. La méthode consiste à effectuer une dilution en série d'une culture dont on aimerait connaître le nombre de cellules. Ensuite, 5 ul de culture dilué sont déposé sur une plaque de Culture solide. Le principe est que ces 5 ul contiennent un nombre de cellules suffisamment petit pour que chacune d'elle se divise en une colonie distincte. Les colonies sont ensuite comptées et le nombre de cellule d'origine est calculé selon la formule suivante : Cells/ml = #colonies*200*dilution.
Protocole détaillé
Cette technique nécessite de travailler sous la hotte de ventilation avec du matériel stérile.
1. Préparer 4 à 6 alicots (1.5 ml) selon la concentration estimée, en ligne sur un portoir et les numéroter. Ajouter 900 ml d'H2O stérile dans chaque tube.
2. Ouvrir la culture liquide à mesurer et récupérer 100 ul qu'on ajoute au tube numéro 1 (dilution 10x). Mélanger up and down avec la pipette et récupérer 100 ul à passer dans le tube numéro 2 (dilution 100x) et ainsi de suite.
3. Préparer une plaque de culture solide et noter sur le couvercle les numéros des tubes correspondant à leur dilution. Déposer 5 ul des dilutions voulues en ligne et attendre 5 à 10 minutes que les gouttes sèchent. Déposer la plaque fermée à l'envers dans l'incubateur à 30 C° et attendre que des petites colonies apparaissent. En général, une nuit.
4. Compter le nombre de colonies à partir de la dilution la plus basse possible. on compte en général les dilutions #4 (10 000x) ou #5 (100 000x). Un comptage d'une cinquantaine à une centaine de colonie donne un résultat plus précis que de compter une dizaine sur la dilution suivante.
5. Calculer selon Cells/ml = #colonies*200*dilution. Exemple : On compte 76 colonies sur la dilution #4. La culture d'origine contenait donc 76*200*10 000 = 1.52e+8 Cells/ml.
Comptage au spectrophotomètre
Test de fermentation forcée
Mesure de gravité
Test d'infection
Souches de levures utilisées par la Nébuleuse
S-23
Propriétés
Souche de Fermentis [1] utilisée pour la production de lagers fruitée.
Bières
- Stirling
- Brewstach
Morphologie et propriétés
Les cellules apparaissent très petites et rondes en grossissement 100x. On distingue bien le nucléole en rouge en augmentant la lumière. Du point de vue des colonies, elles apparaissent très petites au bout de 24h sur milieu riche en malte, contrairement à la S-04 qui pousse plus rapidement.