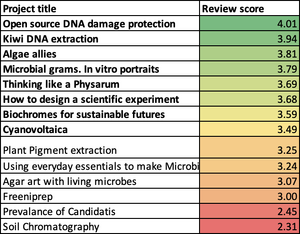
Difference between revisions of "Micronuclei(fr)"
| (21 intermediate revisions by the same user not shown) | |||
| Line 2: | Line 2: | ||
<br> | <br> | ||
=='''Protocole pour tests de micronoyaux sur cellules buccales'''== | =='''Protocole pour tests de micronoyaux sur cellules buccales'''== | ||
| + | par Rachel Aronoff pour les [http://wiki.hackuarium.ch/w/AGiR!_for_genomic_integrity projets de l'intégrité génomique] au Hackuarium. <br> | ||
<br> | <br> | ||
| − | par | + | (avec aide traductions :-) par Anne-Laure Pittet et Juliette Lemaignen) |
| + | et [http://wiki.hackuarium.ch/w/Micronucl voici la protocole en anglais]! | ||
<br> | <br> | ||
| − | |||
| − | |||
<br> | <br> | ||
| + | (Comme tous les microbiologistes moléculaires le savent, chaque chercheur aura sa propre manière de faire… à notre avis plusieurs méthodes sont possibles et devraient être diffusées.) | ||
<br> | <br> | ||
| − | |||
<br> | <br> | ||
'''Un protocole de recherche « Do-It-Together (DIT)» c’est-à-dire « à faire ensemble » pour rechercher des micronoyaux dans ses propres cellules buccales''' | '''Un protocole de recherche « Do-It-Together (DIT)» c’est-à-dire « à faire ensemble » pour rechercher des micronoyaux dans ses propres cellules buccales''' | ||
| Line 25: | Line 25: | ||
*Centrifuger doucement (pas plus de 5 000 rpm / min) pendant 3 min | *Centrifuger doucement (pas plus de 5 000 rpm / min) pendant 3 min | ||
*Verser les surnageants et répéter jusqu'à ce que toutes les cellules soient recueillies | *Verser les surnageants et répéter jusqu'à ce que toutes les cellules soient recueillies | ||
| − | * | + | *rassembler les cellules des deux tubes dans un seul tube, dans environ 200ul de solution saline |
*Obtenir la concentration des cellules de cette solution (but à atteindre: 2000-5000 cellules par lame), en utilisant un hémocytomètre. | *Obtenir la concentration des cellules de cette solution (but à atteindre: 2000-5000 cellules par lame), en utilisant un hémocytomètre. | ||
| − | *Déposer 10ul pour compter sur l'hémocytomètre (le calcul est le suivant, si vous comptez plusieurs cellules (X) de la taille du carré principal = (X * # cellules / X) par carré principal x10 ^ 4 / ml) | + | *Déposer 10ul pour compter les cellules sur l'hémocytomètre (le calcul est le suivant, si vous comptez plusieurs cellules (X) de la taille du carré principal = (X * # cellules / X) par carré principal x10 ^ 4 / ml) |
*Si nécessaire, centrifuger à nouveau pour concentrer les cellules dans un petit volume, puisqu' idéalement, les ’smears' (ou 'raclements' des cellules) déposeront sur chaque lame des gouttes de moins de 50-100 μl, contenant environ 2000 cellules. | *Si nécessaire, centrifuger à nouveau pour concentrer les cellules dans un petit volume, puisqu' idéalement, les ’smears' (ou 'raclements' des cellules) déposeront sur chaque lame des gouttes de moins de 50-100 μl, contenant environ 2000 cellules. | ||
*Assurez-vous que les lames sont propres et étiquetées avant de procéder aux ’smears' ou raclements des cellules | *Assurez-vous que les lames sont propres et étiquetées avant de procéder aux ’smears' ou raclements des cellules | ||
(''à montrer au course des ateliers'') | (''à montrer au course des ateliers'') | ||
| − | *Déposer une goutte aux 3/4 environ à la fin de la lame puis, avec le bord d'une deuxième lame propre, déplacer la goutte vers l'arrière, puis l'étaler (racler) sur tout l'avant de la lame (''voir images'') | + | *Déposer une goutte aux 3/4 environ à la fin de la lame puis, avec le bord d'une deuxième lame propre, déplacer la goutte vers l'arrière, puis l'étaler (racler) sur tout l'avant de la lame (''[http://wiki.hackuarium.ch/w/File:Micronuclei@Hackuarium.jpg voir images dans le version anglais]'') |
*Laissez chaque lame sécher à l’air (on peut placer sur une plaque chaude). | *Laissez chaque lame sécher à l’air (on peut placer sur une plaque chaude). | ||
| Line 39: | Line 39: | ||
(''Fixation facultative avec du méthanol: acide acétique 3:1''). | (''Fixation facultative avec du méthanol: acide acétique 3:1''). | ||
*Colorer les cellules avec du bleu de méthylène (solution aqueuse à 0,5% et pour le fixation optionnelle – solution préparée dans de l'éthanol ...) | *Colorer les cellules avec du bleu de méthylène (solution aqueuse à 0,5% et pour le fixation optionnelle – solution préparée dans de l'éthanol ...) | ||
| − | Si vous avez des conteneurs de trempage pour les lames (cuvettes de coplin), c'est bien. Sinon vous pouvez juste verser une goutte sur la lame. Laisser | + | Si vous avez des conteneurs de trempage pour les lames (cuvettes de coplin), c'est bien. Sinon vous pouvez juste verser une goutte sur la lame. Laisser colorer au moins 1 min puis rincer avec des gouttes d'eau, en recueillant le liquide de déchet bleu (déchet)* dans un bécher. Laisser sécher l'échantillon et examiner au microscope à un grossissement d'environ 200x. |
La quantification est cruciale - les micronoyaux peuvent provenir de processus normaux, mais une augmentation de 2-4 / 1000 à 20 ou plus pour 1000 cellules de la joue pourrait signifier qu'on devrait considérer des expositions environnementales délétères ... | La quantification est cruciale - les micronoyaux peuvent provenir de processus normaux, mais une augmentation de 2-4 / 1000 à 20 ou plus pour 1000 cellules de la joue pourrait signifier qu'on devrait considérer des expositions environnementales délétères ... | ||
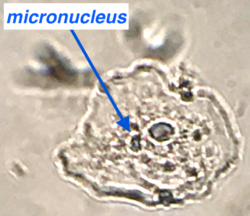
| − | La figure 1 montre un exemple de cellule | + | La figure 1 montre un exemple de cellule buccale contenant un micronoyau, étalé, fixé et coloré simplement avec du bleu de méthylène. |
| + | [[File:Micronuclex.png|250px]] | ||
| + | |||
| + | |||
| + | [https://prezi.com/cymlvpc4qpyk/?utm_campaign=share&utm_medium=copy&rc=ex0share Prezi pour un atelier micronoyaux (de 18may19)] | ||
| + | |||
| + | et si on mettrait le 'timelapse' fait durant [https://vimeo.com/337737746 ici (mit dans Vimeo!)]?? | ||
| + | |||
| + | '''Une première vraie expérience !? ''' <br> Pour un atelier récent sur le micronoyau (18mai19), deux soeurs nous ont donné leurs cellules pour tester à l’aveugle (avec les échantillons A et B).<br> | ||
| + | Après avoir compté 2 lames pour chacune (> 2000 cellules), l’une avait environ 3 micronoyaux pour 1000 cellules et l’autre environ 11, mais c’était dans le sens opposé de ce que j’avais prédit! (La sœur plus sportive en avait plus…).<br> | ||
| + | Quoi qu’il en soit, les deux sont dans la plage ‘normale / basse’! (essentiellement la même)<br> | ||
| + | C’est avec plus de 20 ou 50 cellules sur 1000 que nous disons qu’il faut reconsidérer les choix de vie (et peut-être consulter un médecin!) !! | ||
| + | |||
| + | '''Un atelier spécial sponsorisé par JOGL/SOPBio''' | ||
| + | |||
| + | pour notre premier atelier sur les micronoyaux en personne depuis le début de la pandémie ! | ||
| + | |||
| + | C'était très sympa... | ||
| + | [[File:Top.png|alt=this has typo still! should be detection not protection|thumb|top score for SOPBio workshop support]] | ||
| + | Nous avons eu un soutien spécial de JOGL/SOPBio pour [https://app.jogl.io/project/1420 la proposition de projet]. | ||
| + | Voici [https://prezi.com/view/PSZHlClFA1qYAOtwAxR4/ RA's Prezi] , bilingual (FR/EN) | ||
| + | [[File:After prezi.jpg|center|thumb|seulement 7 participants, en comptant Dujana - mais 2 étaient entièrement nouveaux au laboratoire...]] | ||
| + | [[File:Making slides.jpg|thumb|bleu de methylène montre les hoyaux]] | ||
| + | et voici quelques photos ! L'une des participantes a fourni des cellules pour un atelier il y a longtemps, et attend avec impatience de pouvoir comparer ses comptages de micronoyaux... (Personne n'est arrivé à 1000 cellules avec de bons noyaux, pour l'instant, mais quelques-uns ont promis de revenir !). | ||
| + | [[File:Labbench.jpg|left|thumb|Prêt!]] | ||
| + | [[File:Stained cells.jpg|center|thumb|cellules bucales colorées]] | ||
Latest revision as of 10:17, 28 February 2023
MICRONOYAUX
Protocole pour tests de micronoyaux sur cellules buccales
par Rachel Aronoff pour les projets de l'intégrité génomique au Hackuarium.
(avec aide traductions :-) par Anne-Laure Pittet et Juliette Lemaignen)
et voici la protocole en anglais!
(Comme tous les microbiologistes moléculaires le savent, chaque chercheur aura sa propre manière de faire… à notre avis plusieurs méthodes sont possibles et devraient être diffusées.)
Un protocole de recherche « Do-It-Together (DIT)» c’est-à-dire « à faire ensemble » pour rechercher des micronoyaux dans ses propres cellules buccales
Remarque: le travail se fait idéalement au moins en binôme de façon à pouvoir échanger lames pour le décompte des cellules après la préparation. Ceci permet d'éviter tout biais.
Protocole:
- Bien rincer la bouche avec de l'eau
- Utiliser une brosse à dents pour recueillir délicatement les cellules de la surface interne de la joue
- Rincer la brosse à dents avec environ 10 ml de solution saline dans un petit bécher de façon à collecter les cellules
- Verser le liquide dans un tube conique de 15 ml pour permettre aux plus grosses amas de cellules de se déposer et
- Mettre la meilleure partie du liquide (evitant les amas en bas) dans deux tubes de microcentrifugation
- Centrifuger doucement (pas plus de 5 000 rpm / min) pendant 3 min
- Verser les surnageants et répéter jusqu'à ce que toutes les cellules soient recueillies
- rassembler les cellules des deux tubes dans un seul tube, dans environ 200ul de solution saline
- Obtenir la concentration des cellules de cette solution (but à atteindre: 2000-5000 cellules par lame), en utilisant un hémocytomètre.
- Déposer 10ul pour compter les cellules sur l'hémocytomètre (le calcul est le suivant, si vous comptez plusieurs cellules (X) de la taille du carré principal = (X * # cellules / X) par carré principal x10 ^ 4 / ml)
- Si nécessaire, centrifuger à nouveau pour concentrer les cellules dans un petit volume, puisqu' idéalement, les ’smears' (ou 'raclements' des cellules) déposeront sur chaque lame des gouttes de moins de 50-100 μl, contenant environ 2000 cellules.
- Assurez-vous que les lames sont propres et étiquetées avant de procéder aux ’smears' ou raclements des cellules
(à montrer au course des ateliers)
- Déposer une goutte aux 3/4 environ à la fin de la lame puis, avec le bord d'une deuxième lame propre, déplacer la goutte vers l'arrière, puis l'étaler (racler) sur tout l'avant de la lame (voir images dans le version anglais)
- Laissez chaque lame sécher à l’air (on peut placer sur une plaque chaude).
- Fixer les cellules à la lame en passant brièvement celle-ci au-dessus d'une flamme (enlever la suie du bas avant de passer à la coloration).
(Fixation facultative avec du méthanol: acide acétique 3:1).
- Colorer les cellules avec du bleu de méthylène (solution aqueuse à 0,5% et pour le fixation optionnelle – solution préparée dans de l'éthanol ...)
Si vous avez des conteneurs de trempage pour les lames (cuvettes de coplin), c'est bien. Sinon vous pouvez juste verser une goutte sur la lame. Laisser colorer au moins 1 min puis rincer avec des gouttes d'eau, en recueillant le liquide de déchet bleu (déchet)* dans un bécher. Laisser sécher l'échantillon et examiner au microscope à un grossissement d'environ 200x.
La quantification est cruciale - les micronoyaux peuvent provenir de processus normaux, mais une augmentation de 2-4 / 1000 à 20 ou plus pour 1000 cellules de la joue pourrait signifier qu'on devrait considérer des expositions environnementales délétères ...
La figure 1 montre un exemple de cellule buccale contenant un micronoyau, étalé, fixé et coloré simplement avec du bleu de méthylène.
Prezi pour un atelier micronoyaux (de 18may19)
et si on mettrait le 'timelapse' fait durant ici (mit dans Vimeo!)??
Une première vraie expérience !?
Pour un atelier récent sur le micronoyau (18mai19), deux soeurs nous ont donné leurs cellules pour tester à l’aveugle (avec les échantillons A et B).
Après avoir compté 2 lames pour chacune (> 2000 cellules), l’une avait environ 3 micronoyaux pour 1000 cellules et l’autre environ 11, mais c’était dans le sens opposé de ce que j’avais prédit! (La sœur plus sportive en avait plus…).
Quoi qu’il en soit, les deux sont dans la plage ‘normale / basse’! (essentiellement la même)
C’est avec plus de 20 ou 50 cellules sur 1000 que nous disons qu’il faut reconsidérer les choix de vie (et peut-être consulter un médecin!) !!
Un atelier spécial sponsorisé par JOGL/SOPBio
pour notre premier atelier sur les micronoyaux en personne depuis le début de la pandémie !
C'était très sympa...
Nous avons eu un soutien spécial de JOGL/SOPBio pour la proposition de projet. Voici RA's Prezi , bilingual (FR/EN)
et voici quelques photos ! L'une des participantes a fourni des cellules pour un atelier il y a longtemps, et attend avec impatience de pouvoir comparer ses comptages de micronoyaux... (Personne n'est arrivé à 1000 cellules avec de bons noyaux, pour l'instant, mais quelques-uns ont promis de revenir !).